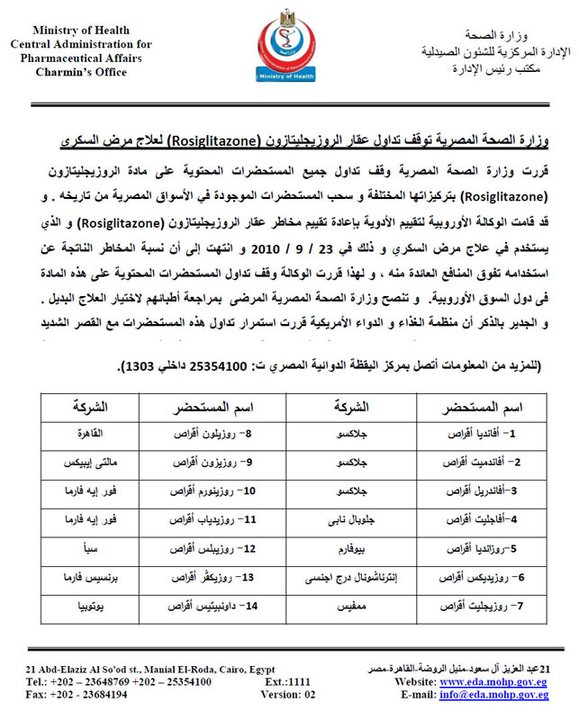
وقف تداول عقار «أفانديا» و13 عقاراً أخرى
قررت وزارة الصحة اليوم السبت، وقف تداول عقار «أفانديا» الذى يعالج مرضى «السكري»، و13 عقاراً أخرى، تدخل فى تصنيعها المادة الفعالة والمستخدمة فى العقار ذاته، وسحب هذه الأدوية من الصيدليات، بسبب المخاطر الصحية الناتجة عن استخدام هذه المستحضرات.
ونصحت الوزارة، فى بيان لها، المرضى، بمراجعة أطبائهم لاختيار علاج جديد، خاصة عقب توصل الوكالة الأوروبية للأدوية إلى أن أضرار استخدام هذه العقاقير أكبر من فوائدها،  وتقنين استخدام عقار «أفانديا» فى الولايات المتحدة الأمريكية وقصر استخدامه على المرضى الذين لا يستجيبون لأدوية السكرى الأخرى.
وتقنين استخدام عقار «أفانديا» فى الولايات المتحدة الأمريكية وقصر استخدامه على المرضى الذين لا يستجيبون لأدوية السكرى الأخرى.
وقال الدكتور أشرف بيومى، رئيس الإدارة المركزية للشؤون الصيدلية، بوزارة الصحة، لـ «المصرى اليوم»: إن الإدارة اتخذت القرار «الأحوط».
من جانبه، قال الدكتور عمرو ممدوح، رئيس شركة «جلاكسو سميث»، المنتجة للعقار فى مصر: «إن الشركة هدفها مصلحة المريض وأنها تعاملت بشفافية مع الأمر، ومنحت وزارة الصحة كل المعلومات ونتائج الاختبارات التى توافرت حول العقار، منذ إنتاجه حتى الآن.
المصدر:
تشير التقارير إلى حدوث 500 حالة من السكتة القلبية و300 حادثة توقف القلب شهريا بسبب هذا الدواء الذي يمكنه إحداث تلف في القلب. يعالج الدواء المذكور أفينديا السكري من النوع الثاني وتسبب بحوالي 304 حالة وفاة في العام الماضي.
ويشير تقرير من إدارة الغذاء والدواء الامريكية FDA، إلى ضرورة سحب الدواء من الأسواق وينصح طبيبان في الإدارة بمنع بيع الدواء المذكور. لكن الجدال في الإدارة حول الدواء لم يحسم بوجود أطراف تؤيد ترك الدواء في الأسواق بسبب عدم وجود دليل حاسم لأخطاره. وخلص نقاش ف يالكونغرس إلى أنه كان على الشركة غلاسكو سميث كلاين GlaxoSmithKline، تحذير المرضى من عواقب جانبية محتملة للدواء المذكور. ولكن الدوار حقق قرابة 3.2 مليارات دولاؤ من المبيعات للشركة في العام 2006
FDA Avandia Warnings
Below are some direct quotes from the FDA on possible side-effects of the prescription drug Avandia:
- Treatment with Avandia may have a 30-40 percent greater risk of heart attack and other heart-related adverse events than patients treated with placebo or other anti-diabetic therapy.
- Safety data from controlled clinical trials have shown that there is a potentially significant increase in the risk of heart attack and heart-related deaths in patients taking Avandia.
- Since the drug was approved, FDA has been monitoring several heart-related adverse events (e.g., fluid retention, edema and congestive heart failure) based on signals seen in previous controlled clinical trials of Avandia alone and in combination with other drugs, and from postmarketing reports.
FDA Announcement:
[09-23-2010] The U.S. Food and Drug Administration announced that it will significantly restrict the use of the diabetes drug Avandia (rosiglitazone) to patients with Type 2 diabetes who cannot control their diabetes on other medications. These new restrictions are in response to data that suggest an elevated risk of cardiovascular events, such as heart attack and stroke, in patients treated with Avandia.
Avandia (rosiglitazone): REMS – Risk of Cardiovascular Events